| Лауриновая кислота | |
| Общие | |
| Хим. формула | C12H24O2 |
| Физические свойства | |
| Молярная масса | 200,3 г/моль |
| Плотность | 0,88 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 44 °C |
| • кипения | 298,9 °C |
| Классификация | |
| Рег. номер CAS | 143-07-7 |
| PubChem | 3893 |
| Рег. номер EINECS | 205-582-1 |
| SMILES | CCCCCCCCCCCC(=O)O |
| InChI | InChI=1S/C12H24O2/c1-2-3-4-5-6-7-8-9-10-11-12(13)14/h2-11H2,1H3,(H,13,14)
POULHZVOKOAJMA-UHFFFAOYSA-N |
| ChEBI | 30805 |
| ChemSpider | 3756 |
| Безопасность | |
| NFPA 704 | 1
1 1 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Лауриновая кислота (12:0)
(
додекановая кислота
) С11Н23COOH — одноосновная предельная карбоновая кислота. Основные источники в рационе человека — кокосовое и пальмоядровое масло. В изолированном виде представляет собой белый порошок со слабым запахом.
Помимо кокосового и пальмоядрового, содержится в более экзотических растительных маслах: масло бабассу (50 %), пальмоядровое масло (47—51 %), масло сливовых косточек (48 %), масло пальмы тукума (Astrocaryum vulgare
) (42,5—48,9 %), масло пальмы мурумуру[
что?
] (
Astrocaryum murumuru
) (42,5 %), кокосовое масло (39—54 %), масло укууба (
Virola surinamensis
) (15—17,6 %), пальмовое масло (менее 0,5 %), масло киви (менее 0,2 %), масло пассифлоры (менее 0,2 %).
Вхождение
Лауриновая кислота, как компонент триглицериды, составляет примерно половину содержания жирных кислот в кокосовое молоко, кокосовое масло, лавровое масло, и пальмоядровое масло (не путать с пальмовое масло),[10][11] В остальном это относительно редко. Он также встречается у человека грудное молоко (6,2% от общего количества жира), коровье молоко (2,9%) и козье молоко (3,1%).[10]
На разных заводах
- Пальма Attalea speciosa
, вид, широко известный в Бразилии как
бабассу
— 50% в
бабассу
масло - Attalea cohune
, пальма когун (также тропическое дерево, масличная американская пальма, пальма корозо или пальма манака) — 46,5% в масло когуна - Astrocaryum murumuru
(Arecaceae) пальма, произрастающая в Амазонии — 47,5% в «масле мурумуру» - Кокосовое масло 49%
- Pycnanthus kombo
(Африканский мускатный орех) - Virola surinamensis
(дикий мускатный орех) 7,8–11,5% - Персиковая пальма семена 10,4%
- Орех бетель 9%
- Финиковая пальма семена 0,56–5,4%
- Дурио Гравеоленс
(разновидность дуриан) 1.31%.[12] - Орех макадамия 0.072–1.1%
- слива 0.35–0.38%
- Арбуз семена 0,33%
- Калина опулус
0.24-0.33%[13] - Citrullus lanatus
(дыня эгуси) - Тыква цветы 205 частей на миллион, тыквенные семечки 472 частей на миллион
У насекомых
- Черный солдат летать Hermetia illucens
30-50 мг / 100 мг жира.[14]
Альфа-гидроксиокислоты АНА (фруктовые кислоты).
Альфа-гидроксиокислоты АНА (фруктовые кислоты) — натуральные биологические вещества, встречающиеся в натуральных продуктах, например, в сахарном тростнике, фруктах, кислом молоке и старом вине.
Молекула альфа-гидроксикислоты содержит карбоксильную и гидроксильную группы и имеет одновременно свойства кислот и спиртов. Присутствие в одной молекуле двух различных химических групп объясняет наличие у альфа-гидроксикислот множества уникальных свойств. Препараты на основе альфа-гидроксикислот широко используются в косметологии для проведения лучшего отшелушивания.
Сырьем для получения АНА служат натуральные продукты.
Отшелушивающее действие АНА происходит благодаря способности ослаблять сцепление (когезию) корнеоцитов в роговом слое. В ответ на усиленное шелушение происходит активация деления клеток базального слоя. А увлажняющее действие — благодаря ускорению обновления эпидермиса. Ускоренное деление клеток базального слоя и быстрое отшелушивание роговых чешуек приводит к тому, что в коже повышается содержание функционально активного NMF. Усиление синтеза гликозаминогликанов и коллагена происходит за счет стимулирующего действия АНА на фибробласты кожи, а также из-за оказываемого «стресса» на дерму.
Пилинги с фруктовыми кислотами – наиболее деликатные, в отличие от других химических составов. АНА-кислоты не оказывают на кожу токсичного воздействия. Чем выше концентрация АНА-кислот, тем лучше омолаживающий эффект, но и сильнее раздражение кожи.
Основное отличие AHA ои BHA кислот в том, что AHA — водорастворимы, в то время как BHA — жирорастворимы.
Кислоты, часто используемые в химических составах:
Гликолевая кислота — содержится в сахарном тростнике, зеленом винограде, ананасе и клене. Среди всех АНА она имеет самую низкую молекулярную массу, что позволяет ей легко проникать в роговой слой и оказывать наиболее выраженный эффект. Гликолевая кислота обладает способностью осветлять следы постакне, бороться с пигментацией, улучшить цвет и текстуру кожи, нейтрализовать воспаления и усилить выработку коллагена. На поверхности гликолевая кислота работает как мягкий эксфолиант.
Молочная кислота — содержится в кислом молоке и йогурте. Обладает отшелушивающими свойствами, а также улучшает гидратацию кожи. Её молекула значительно больше, чем молекула гликолевой кислоты, поэтому проникая в кожу медленнее, она оказывает меньшее раздражение и покраснение. Является основным компонентом естественного увлажняющего фактора кожи. Получают молочную кислоту из лактозы кисломолочных продуктов и йогурта.
Яблочная кислота — содержится во многих фруктах, особенно много в яблоках, грушах и помидорах. Стимулирует клетки, усиливая клеточный метаболизм, обладает отшелушивающим эффектом и работает как антиоксидант. Молекулы яблочной кислоты больше, чем молекулы гликолевой и молочной кислот. Лучше всего действует в концентрации от 1% до 2% и хорошо работает в сочетании с другими AHA.
Тартаровая (винная) кислота — содержится в свободном или этерифицрованном виде в зрелом винограде, старом вине, апельсинах. Обладает отшелушивающими, отбеливающими и увлажняющими свойствами. Молекулы винной кислоты почти в два раза больше молекул гликолевой кислоты. Лучше её применять для поддержания надлежащего уровня pH кожи, чтобы позволить другим AHA приносить максимальную пользу.
Лимонная кислота — содержится в плодах цитрусовых (лимон, лайм, грейпфрут, апельсин). Самая высокая молекулярная масса именно у нее из всех перечисленных. Оказывает на кожу отбеливающее воздействие, которое усиливается в присутствии винной кислоты. Обладает антиоксидантными и бактерицидными свойствами.
Салициловая кислота — гидроксикислота, содержащая фенольную группу. Это не АНА кислота, но комбинируется с фруктовыми кислотами для усиления эксфолиации. Обладает выраженными антисептическими, противогрибковыми и кератолитическими свойствами.
Преимущества АНА кислот:
- Отшелушивающий эффект, без раздражения кожи. При использовании АНА нет необходимости в дополнительном механическом воздействии на кожу с целью удаления роговых чешуек.
- АНА облегчают проникновение в кожу любых косметических средств, повышая их эффективность.
- Активизируют регенерацию клеток кожи, стимулируют синтез коллагена и гликозаминогликанов.
- Обладают отбеливающим действием.
- Можно использовать при любых типах кожи.
- Оказывают антиоксидантное, увлажняющее и противовоспалительное действие.
- Повышают эластичность кожи и уменьшают глубину морщин.
Противопоказания к применению AHA кислот:
- индивидуальная непереносимость;
- повышенная чувствительность кожи;
- свежие травмы кожи;
- герпетические высыпания;
- телеангиэктазия;
- длительное пребывание на солнце.
Четкого подтверждения того, что АНА-кислоты увеличивают чувствительность к ультрафиолету, до сих пор нет. Все же при проведении процедур или использовании косметики с фруктовыми кислотами лучше использовать солнцезащитный крем с фактором не меньше 15, чтобы предотвратить дальнейшее повреждение кожи УФ лучами.
Телефоны Учебного : 8-812-248-99-34, 8-812-248-99-38, 8-812-243-91-63, 8-929-105-68-44
Заявка на заказ продукции здесь
График семинаров здесь
Материал подготовлен с помощью общедоступных источников.
Характеристики
Хотя 95% триглицеридов со средней длиной цепи всасываются через воротная веначерез него абсорбируется только 25–30% лауриновой кислоты.[15]
Как и многие другие жирные кислоты, лауриновая кислота недорога, имеет длительный срок хранения, нетоксична и безопасна в обращении. Он используется в основном для производства мыло и косметика. Для этих целей лауриновая кислота реагирует с едкий натр давать лаурат натрия, который является мыло. Чаще всего лаурат натрия получают омыление различных масел, таких как кокосовое масло. Эти предшественники дают смеси лаурата натрия и других мыл.[11]
Лабораторное использование
В лаборатории лауриновую кислоту можно использовать для исследования молярная масса неизвестного вещества через депрессия точки замерзания. Выбор лауриновой кислоты удобен, потому что температура плавления чистого соединения относительно высока (43,8 ° C). Его криоскопическая постоянная составляет 3,9 ° C · кг / моль. Путем плавления лауриновой кислоты с неизвестным веществом, давая ей остыть и регистрируя температуру, при которой смесь замерзает, можно определить молярную массу неизвестного соединения.[16][нужна цитата
]
Возможные лечебные свойства
Лауриновая кислота увеличивает общий уровень сыворотки холестерин больше, чем у многих других жирных кислот, но в основном липопротеины высокой плотности (ЛПВП) («хороший» холестерин в крови). В результате лауриновая кислота была охарактеризована как имеющая «более благоприятный эффект на общий холестерин ЛПВП, чем любая другая [исследованная] жирная кислота, насыщенная или ненасыщенная».[17] В целом более низкое соотношение общего холестерина / холестерина в сыворотке крови ЛПВП коррелирует со снижением риска атеросклероза.[18] Тем не менее, обширный метаанализ продуктов, влияющих на общую ЛПНПОтношение холестерина к холестерину сыворотки, обнаруженное в 2003 году, чистое влияние лауриновой кислоты на исходы ишемической болезни сердца оставалось неопределенным.[19] Обзор кокосового масла (которое почти наполовину состоит из лауриновой кислоты) в 2021 г. также не дал окончательных выводов о влиянии на сердечно-сосудистые заболевания риск.[15]
Альфа-монолаурин
Альфа-монолаурин: моноглицериды – будущее органических кислот?
Органические кислоты, такие как муравьиная, масляная, яблочная, молочная и другие используются в кормлении животных уже продолжительное время и доказали свою высокую эффективность. Используют их с различными целями: как для снижения кислотосвязывающей способности кормов и повышения усвоения питательных веществ, так и для консервации кормов и антибактериального действия в желудочно-кишечном тракте у животных. Также, именно органические кислоты в связке с другими добавками, рассматривают в качестве перспективной замены кормовым антибиотикам.
I. Соединения органических кислот, используемые в кормлении животных
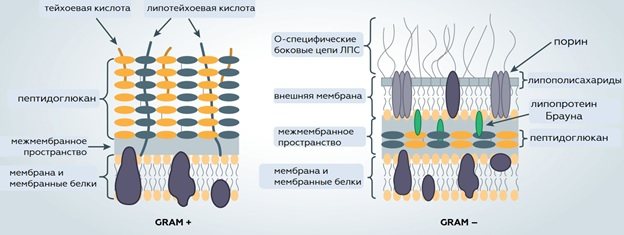
Короткоцепочечные жирные кислоты хорошо проникают через клеточные стенки грамотрицательных бактерий (E.coli, Salmonella spp. и другие) и подавляют их рост и развитие, но малоэффективны против грамположительных бактерий, чья толстая клеточная стенка не подвержена действию большинства органических кислот, применяемых в кормах.
Среднецепочечные жирные кислоты (СЦЖК) — каприловая, каприновая и лауриновая кислоты, в отличие от большинства кислот имеют выраженное действие именно на грамположительные микророганизмы (Clostridium spp., Listeria spp., Staphylococcus spp. и другие) поэтому лауриновую кислоту последние годы все чаще используют для борьбы с такими заболеваниями как некротический энтерит у бройлеров и стрептококкоз свиней. Действие СЦЖК против грамотрицательных бактерий выражено в меньшей степени, поэтому рекомендуется использовать лауриновую/каприловую кислоту в комбинациях с короткоцепочечными органическими кислотами или другими антибактериальными препаратами, например, фитобиотиками.
При всех преимуществах органически кислот в кормлении, они также имеют и недостатки: 1. Коррозийность – органические кислоты приводят к порче оборудования комбикормовых и премиксных заводов. 2. Раздражающее действие – если они дозируются вручную, сотрудникам необходимо использовать маски, перчатки и защитные очки, чтобы избежать повреждения кожи и слизистых. 3. Неприятный вкус и запах для животных – высокие дозировки органических кислот в кормах могут привести к снижению потребления корма, что обязательно отразится на продуктивности. 4. Зависимость от pH – кислоты диссоциируют в зависимости от водородного показателя среды.
Например, константа диссоциации муравьиной кислоты равна 3,75 ед. pH, то есть эта кислота нейтрализуется в двенадцатиперстной кишке животного и уже не оказывает своего действия в большей части тонкого кишечника и в толстом кишечнике. Для предотвращения разрушения кислот прибегают к различным технологическим ухищрениям, таким как защита кислот жировой капсулой для замедленного высвобождения на всем протяжении ЖКТ как в продукте Менацид 130 и Менацид 330 или защита буферными солями для прохождения желудка без диссоциации, как в продукте Бутирекс С4. Но в любом случае, преимущества органических кислот перевешивают их недостатки и в настоящее время сложно оспорить их эффективность в рационах.
II. Моноглицериды органических кислот
Значительную часть функций органических кислот могут перенять на себя моноглицериды органических кислот. На примере альфа-монолаурина (1-моноглицерид лауриновой кислоты) рассмотрим их строение:
Моноглицериды представляют собой соединение органической кислоты с многоатомным спиртом глицерином. От чистых органических кислот и их солей моноглицериды выгодно отличаются по многим параметрам:
1. Некоррозийны
– из-за отсутствия свободных ионов водорода, моноглицериды не взаимодействуют с металлами или компонентами кормов, то есть не приводят к порче оборудования или снижению питательности комбикорма.
2. Не раздражают слизистые
– при ручном дозировании сотрудникам нет необходимости использовать перчатки или респираторы.
3. Нейтральный вкус и запах
– введение моноглицеридов в рацион не приводит к снижению потребления корма, нет необходимости скрывать их вкус или запах.
4. Термостабильны
– не разрушаются при гранулировании или экструдировании кормов даже при
160 ºС!5. pH резистентны
– моноглицериды не имеют константы диссоциации, то есть не нейтрализуются в желудке и кишечнике и сохраняют свою эффективность на всем протяжении желудочно-кишечного тракта.
Основные минусы чистых органических кислот у моноглицеридов полностью отсутствуют. При этом, антибактериальный эффект α-монолаурина в 27 раз выше, чем у лауриновой кислоты!
Но стоит учитывать то, что моноглицериды из-за особенностей молекулы не способны подкислять содержимое желудка и кишечника, то есть эти соединения эффективно дополняют органические кислоты в рационах, а не заменяют их.
Сравнение антибактериального действия лауриновой кислоты и её α-моноглицерида, МИК, μg/мл
| Компонент | Streptococcus A | Streptococcus B | Corynebacterium | Candida | S.Aureus | S.Epidermis |
| Лауриновая к-та | 1,24 | 2,49 | 0,124 | 2,49 | 2,49 | 2,49 |
| Монолаурин | 0,045 | 0,045 | 0,09 | 0,09 | 0,09 | 0,09 |
| Усиление эффекта | 27,6х | 55,3х | 1,4х | 27,7х | 27,7х | 27,7х |
| Hierholzer & Kabara, 1982 | ||||||
III. Моноглицериды – различия в строении
При выборе продукта на основе моноглицеридов стоит обратить внимание на принципиальную разницу между 1-моноглицеридами (альфа-монолгицеридами) и 2-моноглицеридами – разница в их эффективности очень велика, и это в первую очередь связано с особенностями их усвоения. Для того, чтобы разобраться, как эти соединения усваиваются, нужно вспомнить основы усвоения жиров (триглицеридов органических кислот) на примере трилаурина, лауриновая кислота в составе которого обладает некоторым антибактериальным действием:
При переваривании, триглицериды (в т.ч. трилаурин) абсорбируются в виде 2-моноглицеридов и свободных жирных кислот после того, как жир эмульгируется и гидролизуется в процессе переваривания. Переваривание жира начинается с воздействия на него лингвальной и желудочной липазы, которые не нуждаются в присутствии желчных солей. Переваривание жира продолжается в двенадцатиперстной кишке, где образуются мицеллы. Под воздействием панкреатической липазы в жировых каплях происходит гидролиз триглицеридов с разрывом связей в позициях sn–1 и sn–3 и образованием свободных жирных кислот и 2-моноглицеридов. Высвобожденная в результате этого процесса свободная лауриновая кислота будет обладать определенным антибактериальным действием. Далее желчь, эмульгирует жир, что является необходимым этапом образования мицелл. Колипаза, которая синтезируется поджелудочной железой, способствует перемещению свободных жирных кислот и 2-моноглицеридов из жировой капли в мицеллы.
Всасывание жиров в стенку кишки происходит в большей степени путем пассивной диффузии жирных кислот и 2-моноглицеридов. После всасывания в энтероциты, 2-моноглицериды и свободные жирные кислоты реэтерифицируются с помощью специфических 2-моноглицерид ацилтрансфераз в триглицериды, которые включаются в хиломикроны для их системного распределения.
Как мы видим, в результате переваривания жира в организме образуются 2-монолглицериды, которые не обладают какой-либо антибактериальной активностью! 2-моноглицериды в любом случае будут усваиваться как жир и не будут обладать каким-либо эффектом кроме обеспечения организма энергией.
Метаболизм 1-моноглицеридов (в том числе альфамонолаурина) осуществляется иначе. В просвете кишечника липазы не распознают альфа-моноглицериды как субстрат, то есть не способны разрушить связь между глицерином и кислотой в позиции sn-1, а после всасывания в энтероциты 1(3)-моноглицериды почти не распознаются как субстрат ацилтрансферазы, по этой причине моноглицериды большей частью перенаправляются в портальную вену и циркулируют в токе крови (где альфамонолаурин и оказывает свое антибактериальное и антивиральное действие), пока не будут подвергнуты β-окислению (как и свободные жирные кислоты) в различных тканях.
IV. Механизм антибактериального действия моноглицеридов
Как было упомянуто ранее, 2-моноглицериды не обладают антибактериальным действием, а 1-моноглицериды имеют как антибактериальное, так и противовирусное действие. Это связано с тем, что эти молекулы имеют разную пространственную структуру и из-за этого разные свойства. Липаза не распознает альфа-монолаурин как жировой субстрат, а многие бактерии используют глицерин в качестве источника энергии, но не способны отличить глицерин от альфа-монолаурина, что также играет роль в его антибактериальном действии.
Механизм действия моноглицеридов среднецепочечных жирных кислот на данный момент полностью не изучен, но известно, что альфа-монолаурин взаимодействует с мембранами грам+ микроорганизмов и посредством этого действия оказывает бактериостатическое и бактерицидное действие. Наличие как минимум 2-х механизмов действия препятствует развитию резистентности к α-монолаурину у микроорганизмов, поэтому эта молекула всерьез рассматривается как альтернатива антибиотикам.
Сравнение антибактериального действия антибиотиков и α-монолаурина, МИК, μg/мл
| Антибиотик | S.Aureus | S.Aureus BAA-42 MBC | S.Aureus BAA-14154 MBC |
| Монолаурин | 1,25 | 2,5 | 15 |
| Ванкомицин | 2,5 | 5 | 30 |
| Пенициллин | 5 | 5 | 35 |
| Стрептомицин | 5 | 5 | 40 |
| Амоксициллин | 5 | 5 | 25 |
| Метициллин | 2,5 | 2,5 | 25 |
| Manohar et al., 2013 | |||
Schlievert & Peterson (2012) провели обширные исследования, пытаясь вызвать устойчивость Staphylococcus aureus к монолаурину. К большинству антибиотиков этот организм вырабатывает резистентность либо в результате модификации мишени, либо путем приобретения гена, кодирующего белок, который позволяет организму обходить антибактериальное вещество или блокировать его. Несмотря на то, что в течение года стафилококк подвергали действию монолаурина в концентрациях, подавляющих рост, не было зафиксировано ни одного мутанта, у которого бы развилась устойчивость к монолаурину. Точно так же не было выявлено мутантов, у которых была бы повышена продукция веществ, которые инактивируют монолаурин. Полученные этими исследователями данные подтверждают, что существует вероятность наличия нескольких бактериальных мишеней для монолаурина, поэтому возникновение устойчивости маловероятно.
В отличие от большинства антибиотиков, α-монолаурин не имеет одной мишени, а взаимодействует с многими системами передачи сигналов в мембране и нарушает их (рассеивание мембранного потенциала и градиентов pH): в малых концентрациях монолаурина это приводит к подавлению выработки экзотоксинов бактериальных клеток, а при большой концентрации и к гибели патогенов.
Высокая липофильность и сильная эмульгирующая способность моноглицеридов широко применяется в пищевой промышленности. Но эти же свойства обеспечивают и высокую эффективность монолаурина как антибактериального вещества. Из всех среднецепочечных жирных кислот, лауриновая кислота и её производное α-монолаурин обладают самым выраженным антибактериальным эффектом за счет того, что длинна углеродной цепи из 12 молекул углерода лауриновой кислоты равна половине ширины мембранного бислоя. Молекулы монолаурина встраиваются во внешний слой мембран грамположительных бактерий и образуют в нем поры. Этот механизм действия сходен с действием лизоцима, некоторых производных тетрамовых кислот и антибиотика реутерина, который вырабатывается одним из представителей нормофлоры кишечника — Lactobacillus reuteri. По всей видимости, схожесть механизма действия монолаурина с естественными метаболитами нормофлоры и иммунитета организма обеспечивает невосприимчивость большинства лактобактерий к этому соединению (Schlievert et al., 2012).
Основная цель применения монолаурина – контроль грам+ патогенов, но на этом его функционал не заканчивается. Он также обладает прямым вирулицидным действием на вирусы с липидной оболочкой, благодаря порообразованию в их липидной оболочке пор, способности препятствовать слиянию вируса с клетками кишечного эпителия, а также благодаря способности монолаурина предотвращать воспаление слизистой оболочки кишечника, необходимое для проникновения некоторых вирусов через поверхность слизистой. Самыми распространенными в животноводстве вирусами с липидной оболочкой можно считать вирусы репродуктивно-респираторного синдрома свиней, вирус гриппа, вирусы болезни Марека, Ньюкасла. Но важно отметить то, что монолаурин не может считаться средством для лечения вирусных заболеваний, он лишь снижает негативные последствия вспышек таких заболеваний (снижение падежа, поддержание продуктивности).
Все вышеупомянутое демонстрирует огромный потенциал α-монолаурина в кормлении в качестве альтернативы многим антибиотикам, а также как средства для профилактики некоторых вирусных заболеваний. Высокая термостабильность, отсутствие зависимости от pH среды, возможность функционировать как в кишечнике, так и в тканях организма позволяют рассматривать монолаурин в качестве особой, более совершенной формы лауриновой кислоты для обеспечения высокой рентабельности вашего производства.
Компания Мисма является эксклюзивным поставщиком Nova ML (100% альфа-монолаурин) на территории РФ.
Материал подготовлен техническим отделом компании Мисма, сентябрь 2021г.
Рекомендации
- ^ абcd
Г., Чуах Т .; Д., Розанна; А., Салмия; Y., Thomas Choong S .; М., Саари (2006). «Жирные кислоты, используемые в качестве материалов с фазовым переходом (ПКМ) для хранения тепловой энергии в строительных материалах» (PDF). Университет Путра Малайзия. Архивировано из оригинал (PDF) на 2014-11-03. Получено 2014-06-22. - ^ абc
Мезаки, Рейджи; Мотидзуки, Масафуми; Огава, Кохей (2000).
Технические данные по смешиванию
(1-е изд.). Elsevier Science B.V. стр. 278. ISBN 0-444-82802-8 . - ^ абcd
Лиде, Дэвид Р., изд. (2009).
CRC Справочник по химии и физике
(90-е изд.). Бока-Ратон, Флорида: CRC Press. ISBN 978-1-4200-9084-0 . - ^ абcd
Додекановая кислота в Linstrom, Peter J .; Маллард, Уильям Г. (ред.);
Веб-книга NIST Chemistry, стандартная справочная база данных NIST номер 69 - ^ абcdеж
Зейделл, Атертон; Линке, Уильям Ф. (1952).
Растворимость неорганических и органических соединений
(3-е изд.). Нью-Йорк: Компания Д. Ван Ностранд. С. 742–743. - ^ абcd
CID 3893 из PubChem - ^ абcd
Сигма-Олдрич Ко., Лауриновая кислота. Проверено 14 июня 2014. - ^ абcd
Vand, V .; Morley, W. M .; Ломер, Т. Р. (1951). «Кристаллическая структура лауриновой кислоты».
Acta Crystallographica
.
4
(4): 324–329. Дои:10.1107 / S0365110X51001069. - ^ абc
Sydow, Эрик фон (1956). «О строении кристаллической формы А лауриновой кислоты» (PDF).
actachemscand.org
. Acta Chemica Scandinavica. Получено 2014-06-14. - ^ аб
Beare-Rogers, J .; Dieffenbacher, A .; Холм, Дж. В. (2001). «Лексикон липидного питания (Технический отчет IUPAC)».
Чистая и прикладная химия
.
73
(4): 685–744. Дои:10.1351 / pac200173040685. S2CID 84492006. - ^ аб
Дэвид Дж. Аннекен, Сабина Бот, Ральф Кристоф, Георг Фиг, Удо Штейнбернер, Альфред Вестфехтель «Жирные кислоты» в Энциклопедии промышленной химии Ульманна 2006, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a10_245.pub2 - Насаруддин, Мохд ханиф; Нур, Нур Кхайрул Иззрин Мохд; Мамат, Хасмади (2013). «Komposisi Proksimat dan Komponen Asid Lemak Durian Kuning (Durio graveolens) Sabah» [Примерный состав и состав жирных кислот желтого дуриана Сабах (Durio graveolens)] (PDF). Sains Malaysiana
(на малайском).
42
(9): 1283–1288. ISSN 0126-6039. OCLC 857479186. Получено 28 ноября 2021. - Зарифихосрошахи; Тугба Муратхан; Кафкас; Окатан (2019). «Различия в содержании летучих и жирных кислот в плодах калины, произрастающих в разных местах». Scientia Horticulturae
.
264
: 109160. Дои:10.1016 / j.scienta.2019.109160. - Montevecchi, G .; Zanasi, L .; Masino, F .; Maistrello, L .; Антонелли, А. (2019). «Черная солдатская муха (Hermetia illucens L.): влияние на целостность жира с использованием различных подходов к уничтожению предкуколок». Журнал насекомых как еда и корм
.
6
(2): 121–131. Дои:10.3920 / JIFF2019.0002. - ^ аб
Эйрес Л., Эйрес М.Ф., Чисхолм А., Браун Р.К. (2016). «Потребление кокосового масла и факторы риска сердечно-сосудистых заболеваний у людей».
Отзывы о питании
.
74
(4): 267–280. Дои:10.1093 / Nutrit / nuw002. ЧВК 4892314. PMID 26946252. - Mensink RP, Zock PL, Kester AD, Katan MB (май 2003 г.). «Влияние пищевых жирных кислот и углеводов на отношение общего сывороточного холестерина к холестерину ЛПВП, а также на липиды и аполипопротеины сыворотки: метаанализ 60 контролируемых испытаний». Американский журнал клинического питания
.
77
(5): 1146–1155. Дои:10.1093 / ajcn / 77.5.1146. ISSN 0002-9165. PMID 12716665. - Thijssen, M.A. и R.P. Mensink. (2005). Жирные кислоты и риск атеросклероза. У Арнольда фон Эккардштейна (ред.) Атеросклероз: диета и лекарства
. Springer. С. 171–172. ISBN 978-3-540-22569-0. - Влияние пищевых жирных кислот и углеводов на соотношение общего сывороточного холестерина к холестерину ЛПВП и на липиды и аполипопротеины сыворотки: метаанализ 60 контролируемых исследований
Секрет уникальных свойств монолаурина раскрыт!
1 . Марк Ф. Маккарти и Джеймс Николантонио. Свойства триглицеридов с лауриновой кислотой. Открытое сердце . 2016; 3 (2): e000467. Опубликовано онлайн 27 июля 2021 г. doi: 10.1136 / openhrt-2016-000467PMCID: PMC4975867 PMID: 27547436
2 . Гарри Дж. Прейсс , Бобби Эчард, Азад Дадгар, Надим Талпур, Виджая Манохар, Мэри Эниг, Дебасис Багчи, Касс Инграм. Влияние эфирных масел и монолаурина на золотистый стафилококк: исследования in vitro и in vivo. Методы Toxicol Mech. 2005; 15 (4): 279-85. DOI: 10.1080 / 15376520590968833
3 . Беатрис Джи Карпо, Вермен М. Вералло-Роуэлл, Джон Кабара. Новая антибактериальная активность монолаурина по сравнению с обычными антибиотиками против организмов, вызывающих кожные инфекции: исследование in vitro. Сравнительное исследование J Drugs Dermatol. 2007 Октябрь; 6 (10): 991-8.
4 . Лорен Боатенг, Ричард Ансонг, Уильям Б. Овусу и Матильда Штайнер-Асиеду. Роль кокосового и пальмового масел в питании, здоровье и национальном развитии: обзор. Гана Med J. 2021 сен; 50 (3): 189–196
5 . Халлдор Тормар, Хильмар Хильмарссон и Гудмундур Бергссон. Стабильные концентрированные эмульсии 1-моноглицерида каприновой кислоты (монокаприна) с микробицидной активностью в отношении пищевых бактерий Campylobacter jejuni , Salmonella spp, Escherichia coli. Appl Environ Microbiol. 2006 Янв; 72 (1): 522–526.
6 . Мюриэль Дюфур, Джанет М. Мэнсон, Филип Дж. Бремер, Жан-Пьер Дюфур, Грегори М. Кук, Робин С. Симмондс. Характеристика устойчивости к монолаурину Enterococcus faecalis. Appl Environ Microbiol. 2007 сен; 73 (17): 5507–5515. Опубликовано онлайн 13 июля 2007 г. doi: 10.1128 / AEM.01013-07
7 . Хуэй Чжан, Хэвэнь Вэй, Иинан Цуй, Гоцюнь Чжао, Фэнцинь Фэн. Антибактериальные взаимодействия монолаурина с обычно используемыми противомикробными средствами и пищевыми компонентами. J Food Sci. 2009 сентябрь; 74 (7): M418-21. DOI: 10.1111 / j.1750-3841.2009.01300.x.
8 . Дмитрий Гиль, Сергей Шуваев, Анастасия Франк-Каменецкая, Владимир Реуков, Кристофер Гросс, Алексей Вертегель. Новое антибактериальное покрытие ортопедических проводов для устранения инфекций пин-тракта. Противомикробные агенты Chemother. 27 июня 2017 г .; 61 (7): e00442-17. DOI: 10.1128 / AAC.00442-17. Печать 2017 июль.
9 . Зейнаб Хассанейн Фахми, Эман Али, Ибрагим Шалши Амира Х. Мохамед. Влияние среднецепочечных насыщенных жирных кислот(монолаурин) на уровни цитокинов в экспериментах на животных, инфецированныхв Entamoeba histolytica и лямблиями. Африканский фармацевтический журнал и Фармакология. 8 (4), стр. 106-114, 29 января 2014 г.DOI: 10.5897 / AJPP2013.3839
10 . Вермен М. Вералло-Роуэлл, Кристин М. Диллагу, Берта С. Сях-Тджундаван. Новые антибактериальные и смягчающие эффекты кокосового и оливкового масла при атопическом дерматите у взрослых. Рандомизированное контролируемое исследование Дерматит. Ноябрь-декабрь 2008 г .; 19 (6): 308-15.
11 . BW Petschow, Р.П. Батема, Л.Л. Форд. Чувствительность Helicobacter pylori к бактерицидным свойствам среднецепочечных моноглицеридов и свободных жирных кислот. Сравнительное исследование. Противомикробные агенты Chemother. 1996 Февраль; 40 (2): 302-6. DOI: 10.1128 / AAC.40.2.302.
12 . CE Isaacs, К.С. Ким, Х. Тормар. Инактивация оболочечных вирусов в жидкостях организма человека очищенными липидами. Обзор Энн Нью-Йорк Академия наук. 1994 6 июня; 724: 457-64. DOI: 10.1111 / j.1749-6632.1994.tb38947.x.
13 . Джеффри Сэндс, Дэвид Оперин, Уоллес Снайпс. Чрезвычайная чувствительность оболочечных вирусов, включая простой герпес, к ненасыщенным моноглицеридам и спиртам с длинной цепью. Антимикробные агенты. Chemother . 1979 Jan; 15 (1): 67–73. DOI: 10.1128 / aac.15.1.67
14 . С. Браун-Скробот, П. М. Шливер, Ф. Ванденеш, Р. П. Новик. Монолаурат глицерина подавляет выработку бета-лактамазы, токсина токсического шока-1 и других экзопротеинов стафилококка, препятствуя передаче сигнала. J Бактериол. Июль 1994; 176 (14): 4204-9. DOI: 10.1128 / jb.176.14.4204-4209.1994.
15 . Шливерт, Дж. Р. Дерингер, М. Х. Ким, С. Дж. Проян, Р. П. Новик. Влияние монолаурата глицерина на рост бактерий и выработку токсинов. Противомикробные агенты. Chemother. 1992 Март; 36 (3): 626-31. DOI: 10.1128 / aac.36.3.626.
16 . Эшли Т. Хаасе, Ева Ракас, Нэнси Шульц-Даркен, Кимберли Л. Вайсграу, Каван С. Рейли, Циншенг Ли, Питер Дж. Саузерн, Меган Ротенбергер, Марни Л. Петерсон, Патрик М. Шливерт. Защита от повторного вагинального заражения высокой дозой SIV с помощью микробицида глицерина монолаурата. PLoS One. 2015; 10(6): e0129465.Опубликовано в Интернете, 2015 г. 9 июня. Doi: 10.1371 / journal.pone.0129465.
17 . Александр Токарский и Дуглас Л. Маршалл. Механизм синергического ингибирования роста Listeria monocytogenes молочной кислотой и монолаурином. Appl Environ Microbiol. 2008 Dec; 74 (23): 7126–7129.
18 . С.Дж. Проян, С. Браун-Скробот, П.М. Шливерт, Ф. Ванденеш и Р.П. Новик. Монолаурат глицерина подавляет выработку бета-лактамазы, токсина токсического шока-1 и других экзопротеинов стафилококка, препятствуя передаче сигнала. J Bacteriol. 1994 июл; 176 (14): 4204–4209.
19 . А Рузин, Р.П. Новик. Эквивалентность лауриновой кислоты и монолаурата глицерина как ингибиторов передачи сигнала у Staphylococcus aureus. J Бактериол. 2000 Май; 182 (9): 2668-71. DOI: 10.1128 / jb.182.9.2668-2671.2000.
20 . Сара М. Дроуз, Роберт Бономо. Три десятилетия ингибиторов бета-лактамаз. Обзор Clin Microbiol Rev. 2010 Янв; 23 (1): 160-201. DOI: 10.1128 / CMR.00037-09.
21 . Беатрис Джи Карпо, Вермен М. Вералло-Роуэлл, Джон Кабара. Новая антибактериальная активность монолаурина по сравнению с обычными антибиотиками против организмов, вызывающих кожные инфекции: исследование in vitro. Сравнительное исследование J Drugs Dermatol. 2007 Октябрь; 6 (10): 991-8.
22 . Анна Гок, Матиас Рат. Эффективность фитохимических и микронутриентов против боррелий: обновленная информация. Ther Adv Infect Dis. 2021 июнь; 3 (3-4): 75–82.
23 . Гарри Дж. Прейсс, Бобби Эчард, Мэри Эниг, Ицхак Брук, Томас Б. Эллиотт. Минимальные подавляющие концентрации эфирных масел трав и монолаурина для грамположительных и грамотрицательных бактерий. Mol Cell Biochem. 2005 апр; 272 (1-2): 29-34. DOI: 10.1007/s11010-005-6604-1.
24 . Синтия Кью Сан, Чармиан Дж. О’Коннор, Энтони М. Робертон. Антибактериальное действие жирных кислот и моноглицеридов против Helicobacter pylor.i ФЭМС Иммунол Мед Микробиол. 2003 15 мая; 36 (1-2): 9-17.
25 . Гудмундур Бергссон, Олафур Штайнгримссон, Халлдор Тормар. Бактерицидное действие жирных кислот и моноглицеридов на Helicobacter pylori. Противомикробные агенты Int J. 2002 Октябрь; 20 (4): 258-62.
26 . Беатрис Джи Карпо, Вермен М. Вералло-Роуэлл, Джон Кабара. Новая антибактериальная активность монолаурина по сравнению с обычными антибиотиками против организмов, вызывающих кожные инфекции: исследование in vitro. Сравнительное исследование J Drugs Dermatol. 2007 Октябрь; 6 (10): 991-8.
27 . Youngseok Ham and Tae-Jong Kim. Ингибиторы активности моноацилглицеринов по образованию биопленок у Aeromonas hydrophila, Streptococcus mutans, Xanthomonas oryzae и Yersinia enterocolitica. Ham and Kim SpringerPlus (2016) 5:1526.
28 . Даниэла Батовская, Ива Т. Тодорова, Ива В. Цветкова, Христо М. Найденский. Антибактериальное исследование жирных кислот со средней длиной цепи и их 1-моноглицеридов: индивидуальные эффекты и синергетические отношения. Pol J Microbiol. 2009; 58 (1): 43-7.
29 . Гарри Дж. Прейсс, Бобби Эчард, Азад Дадгар, Надим Талпур, Виджая Манохар, Мэри Эниг, Дебасис Багчи, Касс Инграм. Влияние эфирных масел и монолаурина на золотистый стафилококк: исследования in vitro и in vivo. Методы Toxicol Mech. 2005; 15 (4): 279-85. DOI: 10.1080 / 15376520590968833.
30 . Гок А., Недзвецки А., Рат М. Оценка in vitro антибактериальной активности фитохимических веществ и микроэлементов против Borrelia burgdorferi и Borrelia garinii. J Appl Microbiol. 2015; 119 (6): 1561-72. DOI: 10.1111 / jam.1297.
31 . Раджеш Арора, Р. Чавла, Рохит Марва, П. Арора, 3 Р. К. Шарма, Винод Кошик, Р. Гоэль, А. Каур, М. Силамбарасан, РП Трипати, JR Bhardwaj. Возможности дополнительной и альтернативной медицины в профилактике пандемии нового гриппа H1N1 (свиной грипп): предотвращение потенциальных бедствий в зародыше. Evid Based Complement Alternat Med. 2011; 2011: 586506. Опубликовано онлайн 13 октября 2010 г. doi: 10.1155 / 2011/586506.
32 . Шари Либерман, Мэри Дж. Эниг, профессор Гарри Г. Прейсс. Обзор монолаурина и лауриновой кислоты: природных вирулицидных и бактерицидных агентов. Альтернативные и дополнительные методы леченияVol. 12, № 6
33 . Далия Селим, Эмили Чен, Бруна Бенсо, Ванесса Парди и Рамиро М. Мурата. Оценка in vitro противогрибковой активности монолаурина в отношении биопленок Candida albicans. PeerJ. 2016; 4: e2148. Опубликовано онлайн, 2021 22 июня. Doi: 10.7717 / peerj.2148. PMCID: PMC4924139. PMID: 27366648.
34 . Гудмундур Бергссон, Йоханн Арнфиннссон, Олафур Штайнгримссон, Халлдор Тормар. Уничтожение Candida albicans in vitro жирными кислотами и моноглицеридами. Антимикробные агенты Chemother. 2001 Nov; 45 (11): 3209–3212.DOI: 10.1128 / AAC.45.11.3209-3212.2001. PMCID: PMC90807. PMID: 11600381
35 . Кристи Л. Страндберг, Марни Л. Петерсон, Ин-Чи Линь, Мелинда К. Пак, Дэвид Дж. Чейз, Патрик М. Шливерт. Монолаурат глицерина подавляет Candida и Gardnerella vaginalis in vitro и in vivo. Антимикробные агенты Chemother. 2010 фев; 54 (2): 597–601.Опубликовано онлайн, 14 декабря 2009 г. doi: 10.1128 / AAC.01151-09. PMCID: PMC2812150. PMID: 2000877
36 . К. Дж. Ведьмак, Р. П. Новик, П. М. Шливерт. Модуляция пролиферации иммунных клеток монолауратом глицерина. Клин Диаг Лаб Иммунол. 1996 Янв; 3 (1): 10-3.
37 . Хамид Рабб. Т-лимфоциты как мост между врожденной и адаптивной иммунными системами: значение для почек. Обзор Kidney Int. 2002 июн; 61 (6): 1935-46. DOI: 10.1046 / j.1523-1755.2002.00378.x.
38 . Шари Либерман, доктор философии, Мэри Г. Эниг, доктор философии, Гарри Г. Прейс. Обзор: Монолаурин и лауриновая кислота. Природные вирулицидные и бактерицидные агенты
39 . Этьен Крото, Кристиан-Александр Кастеллано, Мари Энн Ришар, Мелани Фортье, Скотт Ньюджент, Мартин Лепаж, Саймон Дюшен, Кевин Уиттингстолл, Эрик Э Туркотт, Кристиан Бокти, Тамас Фюлёп, Стивен Куннейн. Кетогенные триглицериды со средней цепью увеличивают метаболизм энергии в головном мозге при болезни Альцгеймера. J Alzheimers Dis. 2018; 64 (2): 551-561. DOI: 10.3233 / JAD-180202.
40 . M-P St-Onge, H. Jones. Повышение окисления жиров при потреблении среднецепочечных триглицеридов по сравнению с длинноцепочечными связано с более низкой начальной массой тела и большей потерей подкожной жировой ткани. Клиническое испытание. 2003 декабрь; 27 (12): 1565-71. DOI: 10.1038 / sj.ijo.0802467.
41 . Vermén M Verallo-Rowel, Kristine M Dillague, Bertha Syah-Tjundawan. Новые антибактериальные и смягчающие эффекты кокосового и оливкового масла при атопическом дерматите у взрослых.
42 . Шари Либерман, Мэри Г. Эниг и профессор Гарри Г. Прейсс. Обзор монолаурина и лауриновой кислоты – природных вирулицидных и бактерицидных агентов. Альтернативные и дополнительные методы лечения 12, вып. 6
43 . Зейнаб Хассанеин, Фахми Эман Али, Ибрагим Амира, Х. Мохамед. Влияние среднецепочечных насыщенных жирных кислот (монолаурина) на уровни цитокинов у экспериментальных животных при инфекции Entamoeba histolytica и Giardia lamblia. Article Number — 0C0410F43049 Vol.8(4), pp. 106-114 , January 2014
44 . Влияние эфирных масел и монолаурина на золотистый стафилококк: исследования in vitro и in vivo. Июль 2005 г. Механизмы и методы токсикологии 15 (4): 279-85.
45 . Хуэй Чжан, Хэвэнь Вэй, Иинан Цуй, Гоцюнь Чжао, Фэнцинь Фэн. Антибактериальные взаимодействия монолаурина с обычно используемыми противомикробными средствами и пищевыми компонентами. J Food Sci. 2009 сентябрь; 74 (7): M418-21. DOI: 10.1111 / j.1750-3841.2009.01300.x.
46 . Гитанджали Редди Белум, Вишванат Редди Белум, Шри Кришна Чайтанья Арудра, Б. С. Н. Редди. Реакция Яриша-Герксхаймера. Обзор Travel Med Infect Dis. Июль-август 2013 г .; 11 (4): 231-7. DOI: 10.1016 / j.tmaid.2013.04.001. Epub 2013 28.
47 . Роланд Нау и Гельмут Эйфферт. Модуляция высвобождения провоспалительных бактериальных соединений антибактериальными средствами: возможное влияние на течение воспаления и исход при сепсисе и менингите. Clin Microbiol Rev. 2002 Jan; 15 (1): 95–110.DOI: 10.1128 / CMR.15.1.95-110.2002. PMCID: PMC118062. PMID: 11781269
48 . Эйден Хагикия, Стефани Йорг, Александр Душа, Йоханнес Берг, Арндт Манцель. Пищевые жирные кислоты напрямую влияют на аутоиммунитет центральной нервной системы через тонкий кишечник. Erratum Immunity 2021 19 апреля; 44 (4): 951-3. DOI: 10.1016 / j.immuni.2016.04.006.
дальнейшее чтение
- Бернер, Луиза А. (1993). Определение роли молочного жира в сбалансированном питании. В книге Джона Э. Кинселлы (ред.) Достижения в исследованиях в области пищевых продуктов и питания — Том 37
. Академическая пресса. стр. 159–166. ISBN 978-0-12-016437-0. - Кабара, Джон Дж. (1978). Фармакологический эффект липидов
. Шампейн, Иллинойс: Американское общество химиков-нефтяников. ISBN 9991817697. - Кабара, Джон Дж. (2008). Жиры полезны и другие секреты — Как насыщенные жиры и холестерин на самом деле полезны для организма
. Североатлантические книги. ISBN 1-55643-690-4.